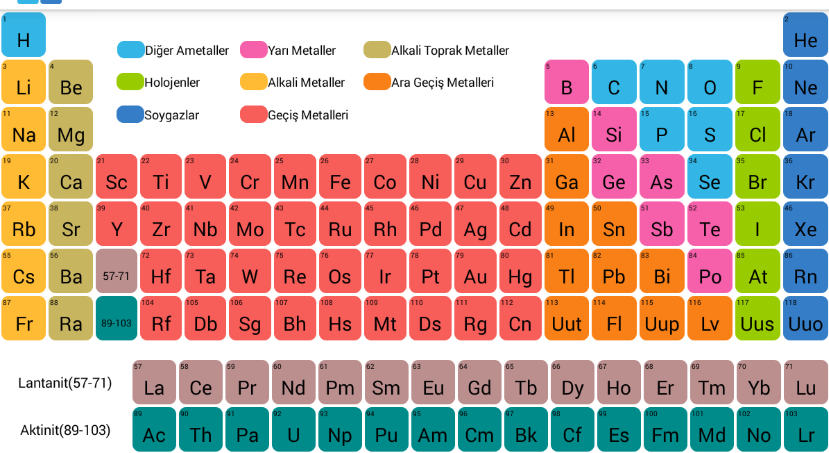
Periyodik tablo
Periyodik tablo elektronik konfigürasyonlarına, atom numaralarına ve ortak kimyasal özelliklerine göre düzenlenmiş çeşitli kimyasal elementlerin tablo şeklinde gösterimidir. Tüm gruplarda ve dönemlerde ortak olan belirli eğilimler vardır.
Satırlar periyot olarak adlandırılır ve tabloda 7 periyot vardır. Metaller sol tarafta, sağ tarafta ise ametaller yer alır. Oysa sütunlar grup olarak adlandırılır. Gruplar halinde elementlerin çeşitli kimyasal davranışları vardır. 18 grup vardır ve halojenler grup 17 altında ve soy gazlar grup 18 altında bulunur.
Periyodik Trendler
Periyodik tabloda bulunan kimyasal elementlerin özelliklerindeki belirli modeller, periyodik trendler olarak bilinir.
- İyonlaşma enerjisi
- Metalik karakter
- Atom Yarıçapları
- Elektronegatiflik
- İyon yarıçapı
- Elektron ilgisi
- Kimyasal reaktivite
- Koruma etkisi
Bu trendler, grupları ve periyotları içindeki elementlerin atomlarının yapısındaki değişikliklerden kaynaklanmaktadır. Birkaç istisna vardır, örneğin grup 3 ve 6’nın iyonlaşma enerjisi istisnadır.
Periyodik Kanun
Periyodik yasa, periyodik trendlerin temelini oluşturur. Periyodik yasaya göre: Kimyasal elementler artan atom numaralarına göre sıralanır ve böylece ana özellikler döngüsel değişikliklere uğrar. Benzer kimyasal özelliklere sahip elementler düzenli aralıklarla tekrar oluşur.
Bu ilke Dmitri Mendeleev tarafından verildi. Ayrıca periyodik tablonun sadece atom ağırlıklarına dayanmadığını, aynı zamanda elementlerin çeşitli fiziksel ve kimyasal özelliklerine de dayandığını belirtti. Özelliklerin yinelenmesinin, atomların dış kabuklarında benzer elektronik konfigürasyonların yinelenmesinden kaynaklandığı da bulundu.
İyonlaşma Enerjisi
İyonlaşma potansiyeli şu şekilde tanımlanabilir:
İhtiyaç duyduğu minimum enerji atomun Nötr veya gaz halindeki bir elektronu uzaklaştırır. Periyot boyunca gidildikçe iyonlaşma enerjisi artar. Bunun nedeni, periyot boyunca nükleer yükün artması ve dolayısıyla elektronların çekirdek tarafından güçlü bir şekilde tutulmasıdır.
Ancak grupta aşağı inildikçe iyonlaşma enerjisi aşağı doğru azalır. Bunun nedeni, grupta aşağı doğru değerlik elektronlarının çekirdekten uzaklaşarak çekirdek yükünün azalmasıdır.
İyonlaşma Enerji Düzeylerini Etkileyen Çeşitli Faktörler
Nükleer şarj
Çekirdek yükü ne kadar düşükse, çekirdek ve değerlik elektronları arasındaki çekim kuvveti de o kadar düşük olur, dolayısıyla iyonlaşma enerjisi de düşük olur.
Koruma etkisi
Nükleer yük arttıkça koruma etkisi artar, dolayısıyla koruma etkisindeki artışla iyonlaşma enerjisi de artar.
Atom Yarıçapı
Atom yarıçapı arttıkça çekirdek ve değerlik elektronları arasındaki çekim kuvveti de azalır. Böylece atom yarıçapı arttıkça iyonlaşma azalır.
Yarı Dolu Değerlik Kabukları
Sözde dolgulu veya yarı dolgulu değerlik kabukları yüksek iyonlaşma enerjisine sahiptir.
Kullanılabilecek basit bir ilke, eğer temel kuantum sayısı düşükse, o kabukta bulunan elektron için iyonlaşma sayısının yüksek olacağıdır.
İstisnalar
Oksijen ve bor ailesindeki tüm elementler, periyodik trendlerin bir istisnasıdır. Her zamanki trendden biraz daha az enerji gerektirirler.
Metalik Mülkiyet
Bir elementin metalik özelliği, elektriği iletme yetenekleri olarak tanımlanabilir. Metalik özellikler, nükleer yük grubu aşağı indirdikçe, grubu aşağı doğru arttırır. Değerlik elektronu çekirdekler tarafından gevşek bir şekilde sınırlandırıldığından elektriği iyi iletebilirler.
Ancak bir süre boyunca, nükleer yük arttıkça metalik karakter azalır. Bu, değerlik elektronları ve çekirdekler arasındaki çekim kuvvetinin artmasına neden olur, böylece elektrik veya ısı iletmelerini engeller.
Atom Yarıçapları
Atom yarıçapı, atom çekirdeği ile dengede olan bir atomun en dıştaki kararlı elektron yörüngesi arasındaki mesafedir. Bir periyot boyunca, nükleer yük arttıkça atom yarıçapı azalır. Azalmanın nedeni, nükleer yük arttıkça çekirdek ile değerlik elektronları arasındaki çekim kuvvetinin de artması ve çekirdeğin elektronu sıkıca tutması dolayısıyla atom yarıçaplarının azalmasıdır.
Bir grupta, atom yarıçapı grupta aşağı doğru artar. Bunun nedeni, yeni mermilerin eklenmesi ve dolayısıyla nükleer yükün azalmasıdır. Ancak atom yarıçapları da bazı istisnalara neden olacak şekilde çapraz olarak artar.
Örnek
Periyod Boyunca – Li> Be > B > C > N > O > F
Gruptan aşağı – Li < Na < K < Rb < Cs
Elektronegatiflik
Elektronegatiflik, bir atomun veya bir molekülün bir çift elektronu çekme yeteneği olarak tanımlanabilir. Bundan dolayı oluşan bağ, esas olarak atomların elektronegatifliği arasındaki farkla belirlenir.
Periyot boyunca, nükleer yük arttıkça elektronegatiflik artar. Bir grupta aşağı doğru hareket ederken, nükleer yük azaldıkça elektronegatiflik azalır. Atomun çekirdeği ile değerlik elektronları arasındaki mesafenin uzun olmasının nedeni elektronların kolayca kaybolmasıdır.
Örnek
Periyod Boyunca- Li < Be < B < C < N < O < F
Gruptan aşağı – Li > Na > K > Rb > Cs
İstisna
Grup 13 elementleri bir istisnadır ve bu nedenle elektronegatiflik alüminyumdan talyuma doğru artar. Ayrıca 14. grupta kalayın elektronegatifliği kurşundan daha yüksektir.
Elektron İlgisi
Elektron ilgisi, bir atomun bir elektronu veya bir elektron çiftini kabul etme eğilimi olarak tanımlanabilir. Bu, anyon olmak için elektron kazandıkları için ametallerin karakteristik bir özelliğidir. Bir periyot boyunca, nükleer yük arttıkça elektron ilgisi artar.
Grupta aşağı doğru, nükleer yük azaldıkça azalır. Flor en yüksek elektronegatifliğe sahiptir ve buna soy gazlar dahil değildir. Bunun nedeni, tam bir değerlik kabuğuna sahip olmalarıdır ve bu nedenle elektron kazanamaz veya kaybedemezler.
Koruma Etkisi
Bir dış elektronun iç elektronlar tarafından itilmesi olarak tanımlanabilir. Ayrıca kaç tane çekirdeğin dış elektronları kontrol edebileceğini açıklamak için de kullanılabilir. Etkili nükleer yük, artan koruma etkisi nedeniyle grubu azaltır. Bir periyot boyunca, nükleer yük arttıkça etkin nükleer yük artar.
İyonik Yarıçap
Bir iyon, sayısız kabuğundaki elektronlardan ve çekirdekten oluşur. Bir iyonun en dış kabuğundaki çekirdek ile elektron arasındaki mesafe, bir iyonun iyonik yarıçapı olarak bilinir. Farklı elementlerin iyon yarıçapına bağlı olarak, periyodik tabloda tanımlanabilecek bir trend var. Temel olarak bu trend şu şekilde görülebilir;
Periyodik tablonun tepesinden aşağıya doğru hareket edersek, elementlerin iyon yarıçapının değeri artacaktır. Bunun nedeni, periyodik tabloda aşağı indikçe elektron katmanlarının veya kabuklarının sayısının artmasıdır.
Periyodik tabloda soldan sağa yana doğru hareket edersek iyon yarıçapı küçülür. Daha fazla proton, elektron ve nötron eklendikçe iyonik boyutun azalması garip görünse de… Bununla birlikte, bunun nedeni, periyodik tabloda yanlara doğru hareket ettikçe metalin katyonlar oluşturmak için dış elektron katmanlarını dökmesidir. Metal olmayanlar için iyonda bulunan elektronların sayısı protonların sayısını aştığında iyonik yarıçap artar, bu da nükleer yükte önemli bir azalmaya neden olur.
Bu trend yalnızca iyon yarıçapı için değil aynı zamanda atom yarıçapı için de geçerlidir, ancak bunlar birbirinden farklıdır.
Kimyasal Reaktivite
Bir elementin reaktivitesi, bir atomun diğer herhangi bir madde ile reaksiyona girme eğilimini ifade eder. Kimyasal reaktivite genellikle iyonlaşma enerjisi (en dış katmandan elektronların ne kadar basit bir şekilde döküldüğü) ve elektronegatiflik (bir atomun başka bir atomun elektronlarını ne kadar hızlı aldığı) tarafından düzenlenir. Elektronların bu transfer ve değiş tokuş süreci, periyodik tabloda kimyasal reaktivite trendinin oluştuğu ilkedir.
Metallerde periyodik cetvelde soldan sağa doğru gidildikçe kimyasal tepkime azalır. Oysa tablonun üstten alt gruplarına doğru gidildikçe tepkisellik artar. Aşağıya veya sola doğru hareket ettikçe elektron alışverişi daha kolay ve daha hızlı hale gelir ve elementlerin kimyasal reaktivitesini arttırır.
Metal olmayanlarda ise tam tersidir. Tablonun solundan sağına doğru gidildikçe kimyasal reaktivite artar. Üst gruplardan alt gruplara doğru gidildikçe reaktivite azalır. Yukarıya veya sağa doğru ne kadar uzağa veya sağa doğru gidildikçe, atomların diğer elektronlar karşılığında elektronlarını atmaları o kadar kolay hale gelir, bu da elektronegatifliği arttırır ve bu da elementlerin kimyasal reaktivitesini daha kesin hale getirir.
Dönem Trendlerine ve Periyodik Tablolara Dayalı Gerçekler
Soy gazların çoğu – helyum(He), neon(Ne), argon(Ar), kripton(Kr), ksenon(Xe) ve radon(Rn)- sıfır elektronegatifliğe sahiptir çünkü son derece kararlıdırlar. Kolayca elektron kaybetmedikleri veya kazanmadıkları için tam değerlik elektronik katmanları vardır.
Periyodik tablonun 118 elementinden 90’ı doğada bulunurken, geri kalan 28’i tamamen insan yapımıdır.
Periyodik tabloda bulunan en hafif element hidrojen(H) iken (sol üst köşede bulunabilir), oganesson (Og) en ağır elementtir (sağ alt köşede bulunabilir)
Periyodik tablodaki elementlerin neredeyse %75’i metaldir. Sadece birkaç metal olmayan mevcuttur.
Oda sıcaklığında sıvı olan sadece iki element brom ve cıvadır.
Periyodik tablo, grup 4 elementi boyunca yarıya katlanırsa, üst üste gelen gruplar, uyumlu elektron yapısına sahip oldukları için birbirleriyle mükemmel bir şekilde kaynaşabilirler. Bu nedenle, tam bir kararlılık içinde bir araya gelirler.